元素及其化合物 · 一 · 「钠及其化合物」
钠单质
化学性质
与 氧气 反应: 与 氯气 反应: 与 水 反应: 现象:「浮熔游响红」
钠的密度比水小,会 浮 在水面上;反应时,钠迅速 熔 化成小球(说明反应剧烈、大量放热、钠熔点偏低);产生的氢气推动钠在水面上 游 动;发出 响 声;滴加酚酞后变 红
与 水溶液 反应: 与 乙醇 反应: 现象:钠沉于无水乙醇的底部(或因产生的氢气使得钠上下跳动),表面有气泡产生,慢慢消失;放出的气体可在空气中安静地燃烧,火焰呈淡蓝色(
);烧杯壁上有水珠生成;澄清石灰水未变浑浊(无 ) 解释:由于烷基具有推电子作用(
),使得 键极性变弱,因此反应不会很剧烈
知识点
制取:
用途:钠、钾合金(液态)可用于原子反应堆的导热剂;冶炼某些金属(如钛金属);用作电光源,制作高压钠灯
密度:
煤油 (密封保存,通常保存在石蜡油或煤油中) 金属钠着火时用细沙覆盖灭火,不得使用水或二氧化碳灭火器
氧化钠与过氧化钠
| 氧化钠( | 过氧化钠( | |
|---|---|---|
| 电子式 | ||
| 离子个数比 | ||
| 化合物类型 | 离子化合物(碱性氧化物) | 离子化合物(非碱性氧化物,为过氧化物) |
| 颜色、状态 | 白色、固体 | 淡黄色、固体 |
| 主要性质 | 具有碱性氧化物的通性 | 具有强氧化性 |
| 稳定性 | 不稳定,加热生成 | 较稳定 |
| 与 水 反应 | ||
| 与 | ||
| 用途 | 制取烧碱( | 漂白剂、消毒剂、供氧剂 |
碱性氧化物与酸反应生成盐和水:
( 不是碱性氧化物: )
具有强氧化性
加入品红溶液中,在水中生成 ,利用其氧化性,使得品红溶液褪色 如将其加入滴加酚酞的水中,
会先变红,后褪色 与
反应: 投入
溶液中生成 沉淀 投入氢硫酸,氧化硫化氢成硫单质,溶液浑浊
氧化
成
考点:
混合溶液的离子数为 考点:
反应产生 ,即转移了
与某水溶液反应与 类似 例如:
与 反应 总方程式:
碳酸钠与碳酸氢钠
| 碳酸钠( | 碳酸氢钠( | |
|---|---|---|
| 俗名 | 纯碱、苏打 | 小苏打 |
| 溶解度 | 易溶于水 | 在水中溶解度比 |
| 热稳定性 | 稳定,受热难分解 | 受热易分解: |
| 与酸反应 | ||
| 与 | 不反应 | |
| 与 | ||
| 与 | 不沉淀 |
碳酸钠的热稳定性比碳酸氢钠更大
使得向饱和
溶液中通入 ,会析出白色晶体 侯氏制碱法中,向饱和
中依次通入 和 ,溶液中存在 ,其中 最先析出,加热析出的 ,得到
和 的顺序不能调换,因为 在 的溶解度较低,通入 会使食盐水呈碱性,从而大量吸收 ,产生 碳酸钠是白色粉末,碳酸氢钠是细小的白色晶体。实验表明,向碳酸钠中加入少量水后,碳酸钠结块变成晶体,并伴随着放热现象。向碳酸氢钠中加入少量水后,碳酸氢钠能溶解,并伴随着吸热现象
碳酸钠和碳酸氢钠的溶液均显碱性,可用作食用碱或工业用碱。
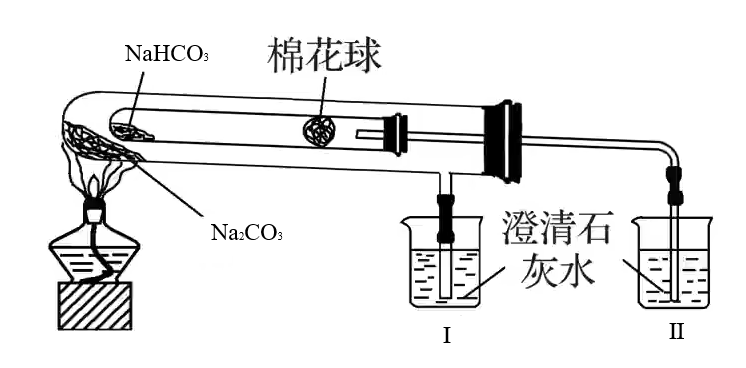
实验:比较碳酸钠与碳酸氢钠的热稳定性
碳酸钠在外层,温度高,碳酸氢钠在内层,温度低,
的澄清石灰水变浑浊,证明碳酸钠的热稳定性更强 实验:辨别
和 互滴。如
逐滴滴入 溶液中,开始时没有气泡,后来有;如 逐滴滴入 溶液中,一开始就有气泡 考点:除去
中的
相互转化:
除杂:
- 固体
加热至恒重 - 水溶液
加 - 水溶液
加足量
鉴别
焰色反应
物理反应,进行焰色反应应使用 铂丝(镍丝、无锈铁丝)。把嵌在玻璃棒上的金属丝在 稀盐酸 里蘸洗后,放在酒精灯的火焰里灼烧,不同金属元素会使火焰变为各种颜色,这便是焰色反应。焰色反应的形成与原子光谱有关
| 离子 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| 焰色 | 红 | 黄 | 紫 | 紫红 | 紫红 | 橙红 | 洋红 | 黄绿 | 绿 |
灼烧白色粉末,火焰呈黄色,证明原粉末中有
,无 解析:能证明有
,但无法确定是否有 ,因为 的黄光会遮盖 的微弱紫光,因此必须透过蓝色钴玻璃过滤黄光,观察是否有紫光 在火焰上灼烧搅拌过某无色溶液的玻璃棒,火焰出现黄色,说明溶液中含有
解析:不能用玻璃棒做焰色实验,因为玻璃棒中含有
,其焰色会干扰实验